CuCl2 là một hợp chất hóa học có công thức là clorua đồng (II), là một muối của đồng và clo. CuCl2 có nhiều ứng dụng trong các lĩnh vực như hóa học, công nghệ, y tế, nông nghiệp và mỹ phẩm.
Trong bài viết này, hãy cùng Ngoaingufpt tìm hiểu về CuCl2 là chất điện li mạnh hay yếu, cũng như các tính chất và phương trình phản ứng liên quan.

1. CuCl2 là gì? CuCl2 Là Chất Điện Li Mạnh Hay Yếu?
- CuCl2 là một chất rắn, màu nâu nhạt, tan tốt trong nước. Hút ẩm tốt, khi có mặt nước chuyển sang màu xanh nhạt
- CuCl2 có khối lượng phân tử là 134,45 g/mol, nhiệt độ nóng chảy là 498 °C và nhiệt độ sôi là 993 °C
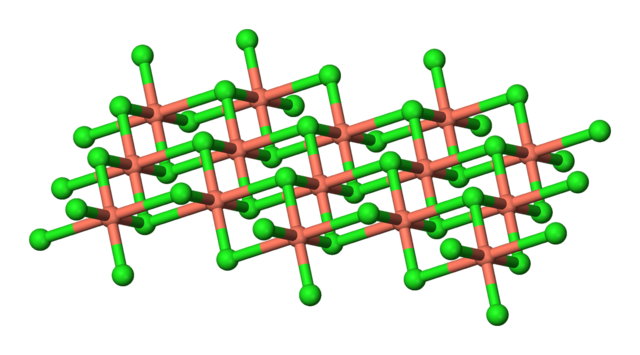
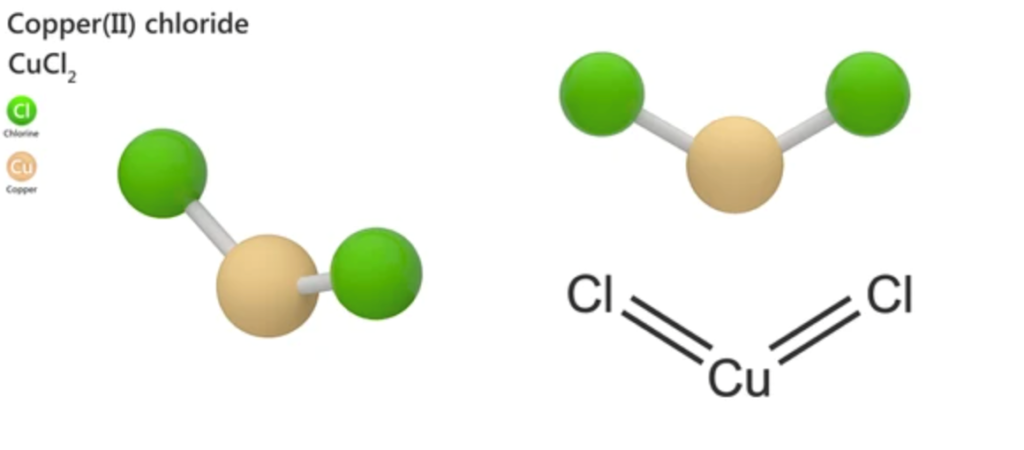
- CuCl2 có cấu trúc phân tử là tâm bát diện, trong đó ion Cu2+ được bao quanh bởi sáu ion Cl-. Cấu trúc phân tử của CuCl2 được minh họa như sau:
2. CuCl2 là chất điện li mạnh hay yếu?
- Để trả lời câu hỏi này, chúng ta cần hiểu khái niệm về chất điện li và sự phân li của chất trong dung dịch nước.
- Chất điện li là chất có khả năng phân ly thành các ion khi tan trong dung dịch nước hoặc ở trạng thái nóng chảy. Các ion này có thể dẫn điện và tham gia vào các phản ứng hóa học.
- Sự phân li của chất điện li trong dung dịch nước có thể được biểu diễn bằng phương trình điện li, trong đó các ion được ký hiệu bằng ký tự (aq) để chỉ rằng chúng tồn tại trong dung dịch. Ví dụ:
NaCl (s) → Na+ (aq) + Cl- (aq)
- Chất điện li có thể được phân loại thành hai loại: chất điện li mạnh và chất điện li yếu.
- Chất điện li mạnh là chất có khả năng phân ly hoàn toàn thành các ion trong dung dịch nước. Nghĩa là, không còn phân tử nguyên thủy của chất điện li trong dung dịch. Ví dụ: NaCl, KNO3, HCl, NaOH…
- Chất điện li yếu là chất có khả năng phân ly chỉ một phần thành các ion trong dung dịch nước. Nghĩa là, vẫn còn một số lượng đáng kể phân tử nguyên thủy của chất điện li trong dung dịch. Ví dụ: CH3COOH, NH4OH, Fe(OH)3, AgCl…
- Để xác định một chất điện li là mạnh hay yếu, có thể dựa vào các tiêu chí sau:
- Độ tan: Chất điện li mạnh thường tan tốt trong nước, trong khi chất điện li yếu thường tan ít hoặc không tan.
- Độ dẫn điện: Chất điện li mạnh thường có độ dẫn điện cao, trong khi chất điện li yếu thường có độ dẫn điện thấp hoặc không dẫn điện.
- Độ phản ứng: Chất điện li mạnh thường phản ứng mạnh với các chất khác, trong khi chất điện li yếu thường phản ứng yếu hoặc không phản ứng.
- Theo các tiêu chí trên, CuCl2 là một chất điện li mạnh, vì:
- CuCl2 tan tốt trong nước, với độ tan là 59,8 g/100 mL ở 25 °C
- CuCl2 có độ dẫn điện cao, với điện trở suất là 0,01 Ω·m ở 25 °C.
- CuCl2 phản ứng mạnh với nhiều chất khác, như kim loại kiềm, axit, bazơ và các muối khác.
- Phương trình điện li của CuCl2 trong dung dịch nước là:
CuCl2 (s) → Cu2+ (aq) + 2Cl- (aq)

3. Các tính chất và phương trình phản ứng của CuCl2
- CuCl2 có nhiều tính chất và phương trình phản ứng đặc trưng, một số ví dụ như sau:
3.1. Tính chất oxi hóa – khử
- CuCl2 có tính chất oxi hóa – khử đa dạng, có thể hoá đỏ hoặc hoá xanh các ion kim loại khác. Ví dụ:
CuCl2 + Zn → ZnCl2 + Cu
CuCl2 + Fe → FeCl3 + Cu
CuCl2 + Sn → SnCl4 + Cu
- Trong các phản ứng trên, ion Cu2+ bị hoá xanh thành kim loại đồng bởi các kim loại kiềm thổ như Zn, Fe và Sn. Các kim loại này bị hoá đỏ thành các ion tương ứng.
3.2. Tính chất axit – bazơ
- CuCl2 có tính chất axit – bazơ phức tạp, có thể tạo thành các muối axit hay bazơ tùy theo điều kiện. Ví dụ:
CuCl2 + H2O ⇌ Cu(OH)Cl + HCl
CuCl2 + NaOH → NaCu(OH)2 + NaCl
CuCl2 + NH3 → [Cu(NH3)4]Cl2
- Trong các phản ứng trên, CuCl2 có thể tạo thành các muối axit như Cu(OH)Cl hay bazơ như NaCu(OH)2 khi tác dụng với nước hay bazơ mạnh. CuCl2 cũng có thể tạo thành các phức chất như [Cu(NH3)4]Cl2 khi tác dụng với bazơ yếu.
3.3. Tính chất màu sắc
- CuCl2 có tính chất màu sắc độc đáo, có thể thay đổi màu sắc theo nồng độ và pH của dung dịch. Ví dụ:
CuCl2 (s) → màu nâu nhạt
CuCl2 (aq) → màu xanh nhạt
[Cu(H2O)6]2+ (aq) → màu xanh lam
[Cu(NH3)4]2+ (aq) → màu xanh da trời
[Cu(OH)4]2- (aq) → màu xanh lá cây
[Cu(CN)4]3- (aq) → màu vàng
[Cu(SCN)4]3- (aq) → màu cam
Trong các phản ứng trên, màu sắc của CuCl2 và các hợp chất của nó có màu sắc khác nhau do sự thay đổi của cấu trúc phân tử và trạng thái oxy hóa của ion Cu2+. Một số ví dụ về cơ chế thay đổi màu sắc của CuCl2 là:
- Khi tan CuCl2 trong nước, ion Cu2+ tạo thành phức chất [Cu(H2O)6]2+ có màu xanh lam. Khi thêm axit vào dung dịch, phức chất này bị phân hủy thành Cu2+ và H2O, dung dịch trở lại màu xanh nhạt.
- Khi tan CuCl2 trong NH3, ion Cu2+ tạo thành phức chất [Cu(NH3)4]2+ có màu xanh da trời. Khi thêm axit vào dung dịch, phức chất này bị phân hủy thành Cu2+ và NH3, dung dịch trở lại màu xanh nhạt.
- Khi tan CuCl2 trong NaOH, ion Cu2+ tạo thành phức chất [Cu(OH)4]2- có màu xanh lá cây. Khi thêm axit vào dung dịch, phức chất này bị phân hủy thành Cu(OH)2 kết tủa và OH-, dung dịch trở lại màu xanh nhạt.
4. Các ứng dụng của CuCl2
- CuCl2 có nhiều ứng dụng trong các lĩnh vực khác nhau, một số ví dụ như sau:
4.1. Ứng dụng trong hóa học
- CuCl2 được sử dụng làm chất xúc tác cho nhiều phản ứng hóa học quan trọng, như:
- Phản ứng Sandmeyer: Là phản ứng thay thế nhóm -NH2 trong các anilin bằng các nhóm khác như -Cl, -Br, -CN, -NO2… Ví dụ:
C6H5NH2 + CuCl2 → C6H5Cl + N2 + Cu
– Phản ứng Wacker: Là phản ứng oxi hóa các olefin thành các aldehit hoặc ceton. Ví dụ:
CH3CH=CH2 + O2 + H2O + CuCl2 → CH3CHO + CH3COOH + Cu
– Phản ứng Deacon: Là phản ứng oxi hóa HCl thành Cl2 bằng O2. Ví dụ:
4HCl + O2 + CuCl2 → 2Cl2 + 2H2O + Cu
4.2. Ứng dụng trong công nghệ
- CuCl2 được sử dụng làm nguyên liệu cho việc sản xuất các loại pin, pin năng lượng mặt trời và pin nhiệt điện.
- CuCl2 cũng được sử dụng làm chất tạo màu cho các loại pháo hoa và đèn lồng. Khi đốt cháy, CuCl2 tạo ra ngọn lửa màu xanh lá cây.
- Ngoài ra, CuCl2 còn được sử dụng làm chất khử cho việc tẩy trắng giấy và vải.
4.3. Ứng dụng trong y tế
- CuCl2 có khả năng diệt khuẩn và kháng viêm, do đó được sử dụng làm chất bảo quản cho các sản phẩm y tế như thuốc nhỏ mắt, thuốc xịt mũi và thuốc rửa miệng.
- CuCl2 cũng được nghiên cứu làm chất điều trị cho một số bệnh lý như ung thư, bệnh Alzheimer và bệnh Parkinson. CuCl2 có thể ức chế sự phát triển của các tế bào ung thư, ngăn chặn sự tích tụ của các protein bất thường trong não và tăng cường hoạt động của các enzyme chống oxy hóa.
4.4. Ứng dụng trong nông nghiệp
- CuCl2 được sử dụng làm chất kích thích cho việc sinh trưởng của các loại cây trồng như lúa, ngô, khoai tây và cà chua. CuCl2 có thể tăng năng suất, chất lượng và khả năng chống chịu của các loại cây trồng này.
- CuCl2 cũng được sử dụng làm chất diệt cỏ và diệt nấm cho việc bảo vệ các loại cây trồng khỏi các loại cỏ dại và nấm mốc. CuCl2 có thể ngăn chặn sự phát triển và lây lan của các loại cỏ dại và nấm mốc này.
4.5. Ứng dụng trong mỹ phẩm
- CuCl2 được sử dụng làm chất tạo màu cho các sản phẩm mỹ phẩm như son môi, phấn mắt, kem nền và sơn móng tay. CuCl2 có thể tạo ra các màu sắc đẹp mắt và an toàn cho da.
- CuCl2 cũng được sử dụng làm chất dưỡng da và chống lão hóa cho các sản phẩm mỹ phẩm như kem dưỡng, serum và mặt nạ. CuCl2 có thể kích thích sản sinh collagen, làm săn chắc da, giảm nếp nhăn và làm mờ vết thâm.
Trên đây là những thông tin giải đáp CuCl2 Là Chất Điện Li Mạnh Hay Yếu? Ngoaingufpt hi vọng bài viết này hữu ích với bạn!